Hochdrucklabor
Navigation Unterseiten

Gase unter Druck
Ein wenig Physik
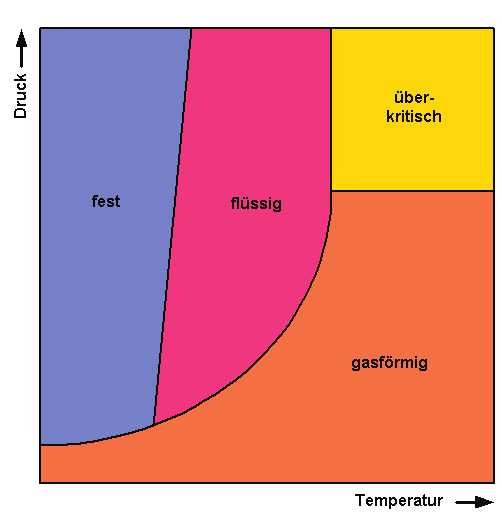
Jeder Stoff kann in verschiedenen Zustandsformen auftreten: fest, flüssig und gasförmig. Beim Wasser heissen die drei Aggregatszustände Eis, Wasser und Dampf. Unterschiedlich starke Anziehungskräfte zwischen den Teilchen eines Stoffes sind dafür verantwortlich; Druck und Temperatur bestimmen das Ausmass dieser Bindungskräfte. Bei tiefer Temperatur sind die Teilchen träge; sie besitzen nicht genug Energie, um sich voneinander loszureissen, sondern rücken nahe zusammen. Dadurch verfestigt sich ein Stoff und wird starr. Die Dichte nimmt zu. Auch Druckausübung auf einen Stoff presst die Teilchen aneinander. Hoher Druck und / oder tiefe Temperaturen begünstigen also den Zustand „fest“, mit sinkendem Druck und / oder steigender Temperatur neigt eine Substanz dazu, flüssig und schliesslich gasförmig zu werden. Die Dichte nimmt ab.
Die Temperaturabhängigkeit des Aggregatzuzstandes ist uns vom Wasser her wohlbekannt: Heisses Wasser kocht und verdampft schliesslich; ein Eisblock schmilzt an der Sonne. Weniger vertraut ist uns die Druckabhängigkeit des Aggregatzustandes: Wasser verdampft im luftleerem Raum bereits bei Raumtemperatur: Die Abhängigkeit des Agrregatzustandes von Druck und Temperatur hat über einen weiten Bereich Gültigkeit, endet aber plötzlich beim sogenanntem kritischem Punkt. Liegen Druck und Temperatur, denen eine Substanz ausgesetzt ist, über dem kritischem Punkt, existiert der Stoff nur noch in gasfluidem Zustand; das heisst der Stoff ist flüssig und nimmt den ganzen zur Verfügung stehenden Raum in Anspruch.
Gase als Lösungsmittel
In der Hochdrucktechnologie werden Gase unter hohem Druck so weit verdichtet, bis sich Anziehungskräfte zwischen den einzelnen Teilchen ausbilden. Durch das entstehende, lockere Beziehungsnetz erhalten die Gase Lösungsmitteleigenschaften; fremde Teilchen können sich in das Netz einbetten wie in eine Flüssigkeit.
Mit steigendem Druck nimmt die Lösungsfähigkeit zu. Durch Variieren von Druck und Temperatur lässt sich die Löslichkeit von Stoffen sehr fein steuern. So wie organische Lösungsmittel oder Wasser, zeigen auch verschiedene Gase ein unterschiedlich gutes Lösungsvermögen für verschiedene Stoffe. Unter den verdichteten Gasen ist Kohlendioxid im überkritischem Zustand – ähnlich dem Wasser – das Universallösungsmittel. Sein kritischer Punkt liegt bei einer Temperatur von 31°C und einem Druck von 73bar. Ein gepumpter Autopneu weist in der Regel einen Druck von 2bar auf. Wer einmal das platzen eines Reifens erlebt hat, weiss welche Wucht dahintersteckt. Bei der Arbeit mit verdichteten Gasen sind die verwendeten Drücke bis 50 mal höher.
Kohlendioxid verfügt über verschiedene Vorteile:
- Es ist physiologisch unbedenklich, was vor allem für die Anwendung in der Nahrungsmittelindustrie von grossem Vorteil ist.
- Die relativ tiefe kritische Temperatur erlaubt seine Verwendung für die Behandlung hitzeempfindlicher Stoffe.
- Es ist nicht explosiv, wie viele andere Gase.
- Es ist umweltfreundlich.
- Es ist in grossen Mengen zu günstigen Konditionen verfügbar.
Die Arbeit mit verdichteten Gasen als Lösungsmittel wird herkömmliche Methoden nie verdrängen, aber sie eröffnet Vorteile in Gebieten, wo die althergebrachte Chemie an Grenzen stösst. Das ist vor allem der Fall bei der Handhabung hitzeempfindlicher Stoffe, Auftrennung komplizierter Stoffgemische, bei hohen Reinheitsanforderungen sowie in der Analytik.
Folgende Vorteile sind mit der Anwendung verdichteter Gase von Bedeutung:
- Die Technologie bietet eine Alternative zu umweltbelastenden Lösungsmitteln, die aufwendige Entsorgungsarbeit verlangen.
- Verdichtete Gase sind gut regenerierbar. Durch eine Temperatur- und / oder Druckänderung kann das reine Gas zurückgewonnen und wieder in den Prozess zurückgeführt werden.
- Die mit der Hochdrucktechnologie gewonnenen Produkte sind lösungsmittelfrei. Durch Entspannen des Systems erreicht man ein vollständiges Entweichen des Gases aus dem Produkt.
- Die Methode erlaubt eine hochselektive Trennung verschiedener Stoffe; durch eine Temperatur- und / oder Druckänderung können selbst Substanzen getrennt werden, die einander ähnlich sind.
- Verdichtete Gase weisen zwar typische Charakteristika von Flüssigkeiten auf. Im überkritischem Bereich herrschen aber zwischen den Teilchen eines verdichteten Gases geringere Anziehungskräfte als zwischen den Molekülen einer Flüssigkeit: Das verdichtete Gas wird lediglich flüssigkeitsähnlich (fluid). Dadurch lassen sich die Moleküle leichter gegeneinander verschieben. Reaktionen in diesem System laufen rund zehnmal schneller ab als in Flüssigkeiten. So können kleinere Reaktionsgefässe eingesetzt werden, um die gleiche Substanzmenge pro Zeiteinheit umzusetzen. Kleinere Reaktionsgefässe bedeuten immer auch geringere Risiken.
Die Nachteile der Technologie liegen vorallem im wirtschaftlichem Bereich. Die druckfesten Apparate und Messgeräte erfordern hohe Investitionskosten. Die Pilotierung eines Verfahrens bis zur fertigen grosstechnischen Anwendung erfordert noch einen grossen zeitlichen und materiellen Aufwand.
Einsatzgebiete

Am weitesten fortgeschritten ist der Bereich der Hochdruckextraktion, der gezielten Herauslösung von Stoffen aus einem biologischem Präparat oder aus einem Stoffgemisch.
Die Methode arbeitet schonend, hochselektiv und ergibt rückstandfreie Produkte. Wichtig sind diese Eigenschaften für die Extraktion von Pflanzenwirkstoffen, die oft sehr Temperaturempfindlich sind, aber auch für den Umgang mit Riechstoffen und Aromen, die keinerlei geruchs- oder geschmacksverfälschende Rückstände enthalten dürfen.
Auch in Kombination mit der Biotechnologie, der jungen Technologie zur Substanzgewinnung, könnte die Hochdrucktextraktion Anwendung finden. Biotechnologisch hergestellte Produkte fallen in stark verdünnten wässrigen Lösungen an und müssen erst mühsam abgetrennt werden. Hier könnten verdichtete Gase gute Dienste leisten und die Stoffe selektiv aus dem Gemisch herauslösen.
Literatur
[1] Dr. Ing. H. Thies, Vorlesungsmanuskript, 1992.
[2] ROCHE Magazin 1989.