Das Diuran-Molekül hat eine Vierfachbindung
- LPC
- Highlights
Die chemischen Eigenschaften der Actinoide sind weniger gut erforscht als die von anderen Elementen. Dies liegt daran, dass sie radioaktiv und daher schwer zu handhaben sind. Auch theoretische Studien zu Actinoiden sind anspruchsvoll wegen der ausgeprägten relativistischen Effekte. PD Dr. Stefan Knecht und einem internationalen Forscherteam gelang es nun, die detaillierteste elektronische Struktur des Diuran-Moleküls U2 zu berechnen und zu zeigen, dass es eine Vierfachbindung bildet.

Um die Reaktivität eines Moleküls zu beschreiben ist es wichtig, die Natur von chemischen Bindungen zu verstehen. In Actinoiden, wie beispielsweise Uran, ist das Untersuchen von Bindungen, der Reaktivität oder der elektronischen Struktur aufgrund der Radioaktivität besonders schwierig. Theoretische Studien zu Actinoiden sind ebenfalls komplexer als zu leichteren Elementen, da die relativistischen Effekte umso ausgeprägter werden, je schwerer ein Element ist. Relativistische Effekte sind der Grund, warum einige Metalle besondere Eigenschaften haben. So hat z.B. Gold hat eine gelb-rötliche Farbe, oder Quecksilber ist bei Raumtemperatur flüssig. Es werden zwei Arten von relativistischen Effekten unterschieden. Auf der einen Seite gibt es skalar-relativistische Effekte, die durch die sehr hohe Geschwindigkeit der Elektronen und die damit verbundene Zunahme ihrer relativistischen Masse verursacht werden. Andererseits gibt es die sogenannte Spin-Bahn-Kopplung, die den Einfluss der geladenen Teilchen im Atom (Protonen und andere Elektronen) auf den Spin eines Elektrons beschreibt. Diese beiden Effekte verändern die Energetik und auch die räumliche Ausdehnung der Atomorbitale im Uranatom signifikant (siehe Abbildung). Die Grenzorbitale 5f, 6d und 7s von zwei Uranatomen sind aufgrund relativistischer Effekte energetisch näher beieinander und ermöglichen es ihnen, im Diuran U2 räumlich besser zu überlappen.
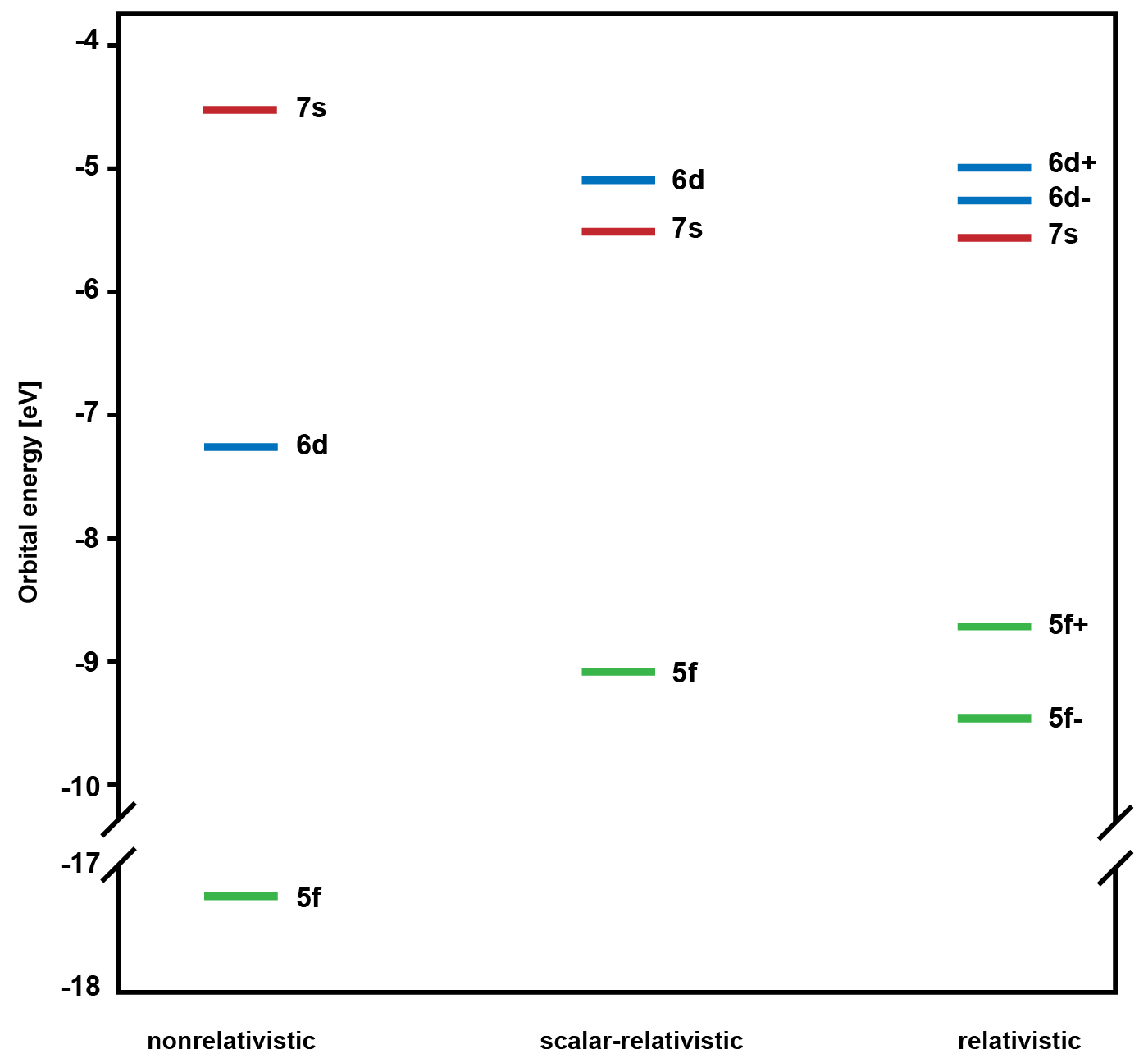
Frühere theoretische Studien zu U2 bezogen nur skalar-relativistische Effekte ein, was zu einer effektiven Bindungsordnung (EBO) von 4.2 führte. Die Multiplizität einer Bindung ist definiert als der Wert, der als niedrigste ganze Zahl grösser als die EBO selbst ist. Für Diuran wurde daher eine Fünffachbindung postuliert. PD Dr. Stefan Knecht und ein Team von internationalen Mitarbeitern konnten nun erstmals die elektronische Struktur des Diuran-Moleküls mit Hilfe quantenchemischer Methoden berechnen. Dabei berücksichtigten sie alle relativistischen Effekte einschliesslich der Spin-Bahn-Kopplung in einem variablen Ansatz. Dies ergab einen anderen elektronischen Grundzustand von U2 und eine EBO von 3.8, was effektiv als Vierfachbindung beschrieben werden kann.
In ihrer Studie beschreiben sie eine der bisher komplexesten elektronischen Strukturen für ein zweiatomiges Molekül, die alle relativistischen Effekte berücksichtigt. "Mit dieser Methode verstehen wir heute nicht nur die elektronische Struktur von Diuran in noch nie dagewesener Detailtiefe, sondern wir können diese Erkenntnisse auch für Simulationen anderer schwerer Elemente einsetzen, welche aufgrund ihrer Radioaktivität sonst nur schwer zu untersuchen sind" sagt Stefan Knecht.
Literaturhinweis
Stefan Knecht1, Hans Jørgen Aa. Jensen2, and Trond Saue3,4
Relativistic Quantum Chemical Calculations Show that the Uranium Molecule U2 Has a Quadruple Bond.
Nature Chemistry 2018. DOI: externe Seite 10.1038/s41557-018-0158-9
1) Laboratorium für Physikalische Chemie, ETH Zurich
2) Department of Physics, Chemistry and Phannacy, University of Southern Denmark
3) Laboratoire de Chimie et Physique Quantiques, IRSAMC, Université Paul Sabatier Toulouse
4) Centre for Advanced Study at the Norwegian Academy of Science and Letters, Drammensveien