Ein hocheffizienter Katalysator für die Produktion von Wasserstoff aus Formaldehyd
- LAC
- Highlights
In ihrer jüngsten Publikation zeigen Prof. Grützmacher und seine Forschungsgruppe, wie Formaldehyd als kleines organisches Molekül zur effizienten Speicherung von Wasserstoff eingesetzt werden kann. Neu entwickelte Diolefin-Rutheniumkomplexe katalysieren die Produktion von H2 aus einer basischen wässrigen Formaldehydlösung.

Energiespeicher benötigt
Am 21. Mai 2017 sagte die Schweizer Ja zur Energiestrategie 2050 und akzeptierten somit das neue Energiegesetz. Dies bedeutet unter anderem eine verstärkte Nutzung erneuerbarer Energieformen und die Förderung der Energieeffizienz. Mit dem Auftrag, sich von der Kernenergie zu befreien, besteht nun die Notwendigkeit, neue und sichere Wege zu entwickeln, Energie zu speichern und zu verteilen. Ein Kandidat für sauberen Treibstoff und Energiespeicher ist Wasserstoff, obwohl er in reiner Form nicht in der Natur vorkommt. Wasserstoff könnte zu Wasser verbrannt oder in einer Brennstoffzelle zur direkten Stromerzeugung verwendet werden. Diese Eigenschaften machen H2 zu einem sehr sauberen Energieträger. Industriell wird Wasserstoff aus Kohlenwasserstoffen durch Dampfreformierung hergestellt. Er kann aber auch ohne fossile Brennstoffe durch Elektrolyse hergestellt werden. Dieses Verfahren nutzt elektrische Energie, um Wasser in O2 und H2 zu spalten – ohne CO2 als chemisches Nebenprodukt.
Molekularer Wasserstoff ist jedoch nicht leicht zu handhaben, ausserdem ist die Speicherung nicht trivial. H2 ist hochentzündlich und mit einem Siedepunkt von –253 °C muss er unter hohem Druck gelagert werden. Für z.B. wasserstoffbetriebene Fahrzeuge bedeuten solche Drucktanks zusätzliches Gewicht. Eine Möglichkeit, die Speicher- und Handhabungsprobleme zu umgehen, ist den Wasserstoff chemisch an ein stabileres Molekül zu binden. Optimal sollte eine solche Verbindung einen relativ hohen Wasserstoffgehalt aufweisen. Eines der kleinsten und somit geeignetsten organischen Moleküle ist Formaldehyd, es kann in Form einer wässrigen Lösung verwendet werden. Die Forschungsgruppe von Prof. Grützmacher entwickelte jetzt ein neues und leistungsstarkes Katalysatorsystem, das unter sehr milden Bedingungen Wasserstoff aus wässrigem Formaldehyd freisetzen kann [1]. Dies macht Formaldehyd zu einem sehr attraktiven H2-Speichersystem mit einem hohen Gewichtsanteil an Wasserstoff.
Ein Katalysator mit bemerkenswerten Eigenschaften
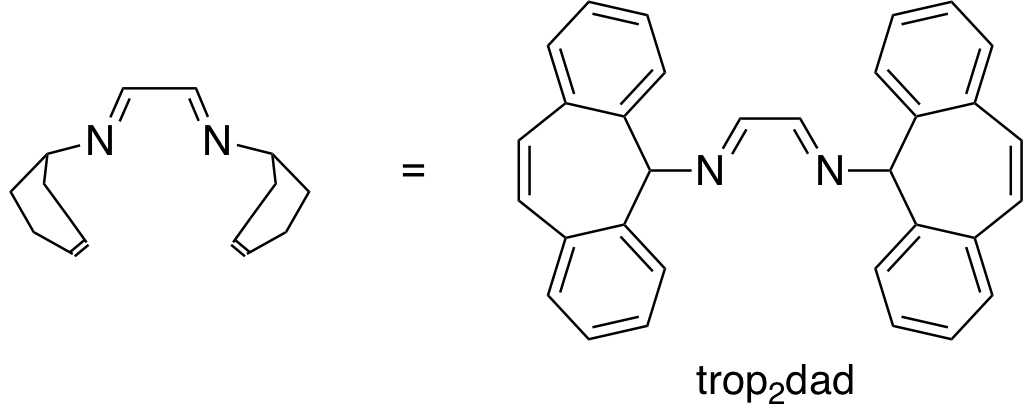
Die Katalysatoren, die H2 aus wässrigen Formaldehydlösungen generieren können, werden von Dr. Monica Trincado, Oberassistentin in der Gruppe von Prof. Grützmacher, und ihren Mitarbeitern entwickelt. Bestehend aus Rutheniummetallkomplexen, haben alle Katalysatoren einen leicht herzustellenden und preiswerten organischen Liganden: trop2dad (ein Beispiel eines Katalysators und der Ligand sind in der untenstehenden Abbildung gezeigt). In basischer Lösung erreichen die Rutheniumkatalysatoren eine hohe katalytische Produktivität (die Anzahl von Katalysezyklen ohne zu degradieren) von bis zu ~ 30'000 und eine hohe Wechselzahl (die Geschwindigkeit, mit der der Katalysator arbeitet) von fast ~ 1'800 h-1. Die Katalysatoren produzieren H2 und Carbonat in hoher Ausbeute bei einer sehr niedrigen Reaktionstemperatur von 60 °C.
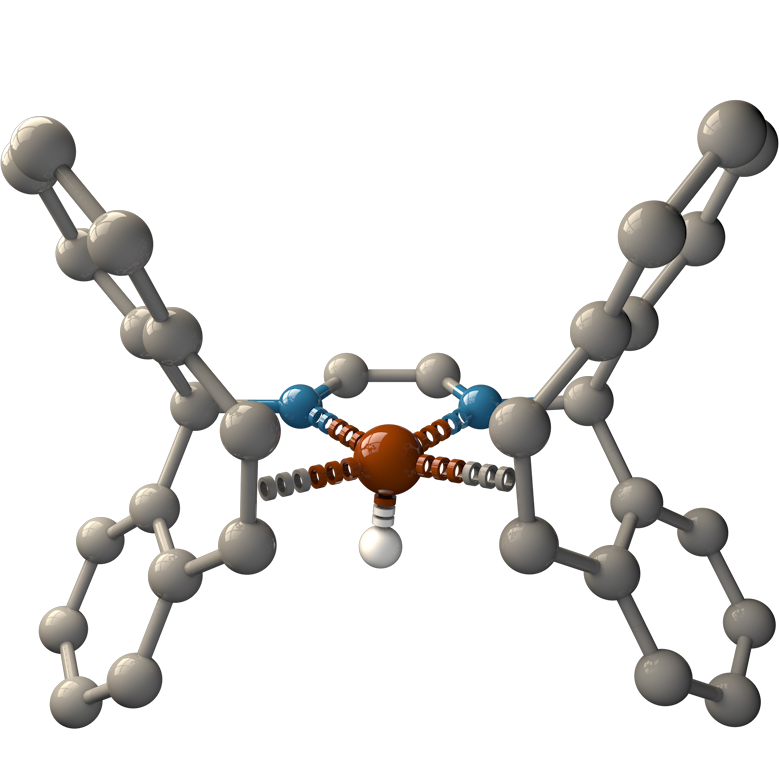
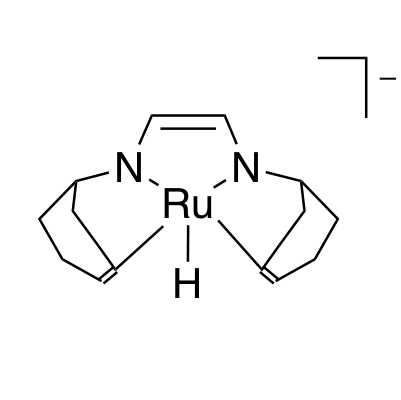
In Formalin, wie die wässrige Lösung von Formaldehyd genannt wird, liegt das Formaldehydmolekül als verschiedene hydratisierte und polymere Spezies vor: beispielsweise Methandiol und Paraformaldehyd. Daher geschieht die katalytische Umwandlung von Formalinlösungen auf verschiedenen Reaktionswegen. In einem der beschriebenen Wege entsteht sogar Kohlenmonoxid als Zwischenprodukt. Kohlenmonoxid kann Katalysatoren “vergiften“ indem es sie vollständig deaktiviert. Nicht so die Rutheniumkatalysatoren. Sie sind extrem anpassungsfähig und funktionieren unter allen genannten Bedingungen – sogar in einer Kohlenmonoxidatmosphäre. Aus diesem Grund nennen Prof. Grützmacher und Dr. Trincado ihre neu entwickelten Rutheniumkomplexe auch „katalytische Chamäleons“.
Dichtefunktionaltheorie (DFT)-Rechnungen untermauern den vorgeschlagenen Reaktionsmechanismus, was darauf hindeutet, dass der Hauptreaktionsweg die Dehydrierung von Methandiol in Lösung ist. Während der Reaktion wechselt das Ruthenium-Zentrum des Komplexes die Oxidationszahl zwischen 0 und +II. Der trop2dad-Ligand beteiligt sich ebenfalls an der Reaktion indem er Wasserstoff vorübergehend speichern kann.
Dr. Trincado weist darauf hin, dass der Katalysator sogar zur Entgiftung von mit Formaldehyd verschmutztem Wasser verwendet werden kann. Dies wurde bereits von anderen Forschungsgruppen getestet, die ein ähnliches katalytischen System entwickelten, das bei sehr verdünnten Formaldehydkonzentrationen hocheffizient arbeitet. Die Endprodukte sind Sprudelwasser und ungiftiges Wasserstoffgas.
Direkt Strom erzeugen
Sein Ziel, sagt Prof. Grützmacher, ist nicht unbedingt die Produktion von gasförmigem Wasserstoff. Sein Plan ist es, mit Hilfe des Katalysators direkt Elektrizität in einer sogenannten "metallorganischen Brennstoffzelle" zu erzeugen. Solche Brennstoffzellen sind ebenfalls Teil seiner Forschung, und er hat bereits in Zusammenarbeit mit der Gruppe von F. Vizza am CNR in Sesto Fiorentino einen ähnlichen Katalysator entwickelt. Dieser funktioniert direkt an der Elektrode, um Strom aus einem Alkohol-Wasser-Gemisch zu erzeugen [2,3]. So kann eine höhere Energieeffizienz erreicht werden und gleichzeitig werden die Nachteile von gasförmigem H2 eliminiert. Zum Schluss weist Prof. Grützmacher darauf hin, dass das Ausgangsmaterial für die Formaldehyd-Synthese in Zukunft recyceltes CO2 und nicht fossile Brennstoffe sein sollten.
Literaturhinweise
[1] Trincado M., Sinha V., Rodriguez-Lugo R. E., Pribanic B., de Bruin B. & Grützmacher H. externe Seite Homogeneously catalysed conversion of aqueous formaldehyde to H2and carbonate Nature Communications, 2017, 8, 14990
[2] Annen S., Bambagioni V., Bevilacqua M., Filippi J., Marchionni A., Oberhauser W.,Schönberg H., Vizza F., Bianchini C. & Grützmacher H. externe Seite A Biologically Inspired Organometallic Fuel Cell (OMFC) That Converts Renewable Alcohols into Energy and Chemicals Angewandte Chemie International Edition, 2010, 49, 7229-7233
[3] Rodriguez-Lugo R. E., Trincado M., Vogt M.,Tewes F., Santiso-Quinones G. & Grützmacher H. externe Seite A homogeneous transition metal complex for clean hydrogen production from methanol–water mixtures Nature Chemistry, 2013, 5, 342-347