
Leuchtende Werkzeuge für lebende Zellen
Zellen verarbeiten ständig komplexe Signale: sei es zwecks Überlebens, Metabolismus, Entwicklung oder Zelltod. Wer sie bei ihrer internen Kommunikation bespitzeln kann, hat in puncto Therapien entscheidende Vorteile. Michelle Frei, neue Assistenzprofessorin für Chemische Biologie und Molekulare Bildgebung, entwickelt mit ihrem Team chemische Werkzeuge, um zelluläre Prozesse durch Fluoreszenz besser sichtbar zu machen und zu untersuchen. In diesem Artikel stellt sie sich vor.
Im dritten „Finger“ des HCI-Gebäudes nimmt Michelle Frei entspannt in ihrem Büro Platz. Ein wenig Homecoming-Feeling, oder? „Teilweise,“ räumt die kürzlich aus den USA heimgekehrte Chemikerin lachend ein.
„Ich komme aus der Schweiz und habe tatsächlich wenige Meter vom jetzigen Büro entfernt bei Prof. François Diederich meine Masterarbeit gemacht. Allerdings verbinde ich die Zeit damals mehr mit dem Studium“, gibt sie zu. Nach ihrem Masterabschluss folgten ein Doktorat und Postdoktorat in Lausanne, Heidelberg und San Diego.“ Seitdem erhellt Michelle Frei die molekulare Welt mit neuen leuchtenden Verbindungen, um zelluläre Prozesse besser visualisieren zu können, z.B. zwecks Messung von Zellsignalen bei Krebs oder anderen Erkrankungen.
Nun kehrt die ehemalige Studentin als Professorin für Chemische Biologie und Molekulare Bildgebung ans Institut für Organische Chemie zurück und möchte ihre Forschung vertiefen – ein neuer Abschnitt, der Heimkehr und Neuanfang zugleich bedeutet: „Dass ich nun in der Schweiz und an der ETH tätig sein darf, ist grossartig. So ein Karriereschritt lässt sich in der Academia kaum vorausplanen.“

Inspirierende Leuchtkäfer und nützliche Lebenszeiten
Leuchtende Verbindungen auf molekularer Ebene haben die Aargauerin schon als Schülerin fasziniert. Glühwürmchen motivierten sie schliesslich während ihres Kanti-Abschlussjahres ein Maturaprojekt über Insekten durchzuführen.
Nach mehrmaliger erfolgreicher Teilnahme an der Chemieolympiade, gefolgt vom Chemiestudium an der ETH Zürich entwickelt Michelle Frei chemische Werkzeuge, die Messungen erleichtern sollen. Während ihres Doktorats bei Prof. Kai Johnsson an der EPFL und dem Max-Planck-Institut für medizinische Forschung forschte sie an fluoreszierenden Farbstoffen für verschiedene Arten der Mikroskopie – und schien dabei nicht ganz uninspiriert von blinkenden Leuchtkäfern.
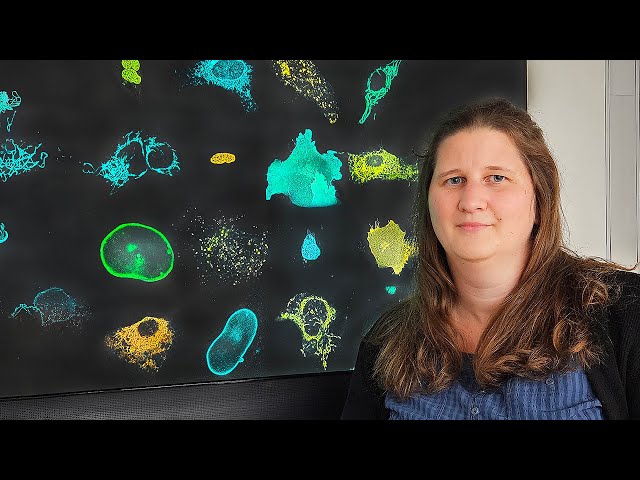
Dazu muss man wissen, dass fluoreszierende Farbstoffe (Fluorophore) gewisse Eigenschaften haben: Werden diese Moleküle – meist rote, blaue oder grüne Farbstoffe – durch Licht angeregt, emittieren sie Licht mit einer bestimmten Wellenlänge und erzeugen ein messbares Signal. So lassen sich unterm Mikroskop spannende Prozesse in Geweben und Zellen beobachten.
Ähnlich wie sich aber die natürlichen Signale von Glühwürmchen bei der Partnersuche in Rhythmus und Länge unterscheiden, findet die Lichtemission auch bei künstlichen Fluorophoren mit unterschiedlicher Verzögerung statt: „Die Zeit, bis der Farbstoff zu leuchten beginnt, nennt sich „Lebenszeit“ – eine bekannte, aber wenig beachtete Eigenschaft“, erläutert Frei.

Ein Fluorophor, mehrere Ziele
Die Chemikerin hatte erkannt, dass sich Fluorophore anhand ihrer Lebenszeit differenzieren lassen. Darauf basierend entwickelte sie in ihrer mehrfach preisgekrönten Dissertation ein neues System, bei dem man mit einem einzigen Farbstoff mehrere Ziele in der Zelle parallel untersuchen kann (Multiplexing-Ansatz). Dafür nutzte sie das gut erprobte HaloTag-Protein.
„Häufig koppelt man Fluorophore an Antikörper, um sie an einen spezifischen Zielort zu bringen. Dies klappt aber nicht mit lebenden Zellen, da die Antikörper zu groß sind. Ich bevorzuge kleinere Tags – Proteine, die von genetisch modifizierten Zellen hergestellt werden können. Wir schleusen dann einen Fluorophor in diese Zellen ein und der Fluorophore hängt sich über ein Bindemolekül selbst an das Tag.“
Normalerweise nutzt man für unterschiedliche Zielorte verschiedene Fluorophore und Tags – eine Herausforderung, da nicht alle Tags gleich gut funktionieren und sich auch die Fluorophore beispielsweise darin unterscheiden, wie leicht sie in eine Zelle gelangen. Michelle Freis neuer Ansatz bestand darin, nur einen Fluorophor zu nutzen und drei Varianten vom erprobten HaloTag-Protein herzustellen – jeweils mit einer anderen Mutation, welche die Lebenszeit und Leuchtkraft des gebundenen Fluorophors beeinflusst.

„Man kann nun für die drei Tag-Varianten denselben Fluorophor verwenden. Da er aber abhängig vom Tag mit unterschiedlicher Zeitverzögerung fluoresziert kann man sie dennoch unterscheiden und mehrere Ziele gleichzeitig anschauen: z.B. den Zellkern, die Zellmembran und die Mitochondrien (Frei et al 2022). Bisher dominierten Einzelmessungen, das heißt das Gesamtbild musste in einem zweiten Schritt zusammengesetzt werden. Dabei gab es immer eine gewisse Unsicherheit, wie die verschiedenen Strukturen miteinander interagieren. Simultane Messungen sind hier besser geeignet."
Stabilere, dunkel-rote Werkzeuge entwickeln
Zudem verfolge sie als Werkzeugentwicklerin immer auch eine Absicht. „Als Postdoc im Labor von Prof. Jin Zhang hatte ich z.B. an Biosensoren geforscht, mit der sich die zelluläre Kinaseaktivität beobachten lässt“, erinnert sich Frei. Kinasen vermitteln viele Signale in der Zelle und regulieren Aktivitäten wie den Zellstoffwechsel, ein wichtiger Faktor auch bei Diabetes. „Wir wussten, dass wir zur Beobachtung solcher Aktivitäten 4D-Bildgebung und idealerweise stabile dunkel-rote Biosensoren brauchen. Die gab es aber bis dahin nicht.“

Michelle Frei integrierte darum den HaloTag und den synthetischen dunkel-roten Fluorophor (Silikonrhodamin) in einen Kinase-Biosensor und schuf damit einen fotostabilen Biosensor, der für diese Art der Bildgebung einsetzbar war. Zusätzlich habe der eingesetzte Fluorophor den Vorteil gehabt, dass sein Farbspektrum orthogonal zu existierenden Sensoren war. „So konnten wir nahe beieinander liegende Fluorophore differenzieren und fünf Signalwege gleichzeitig beobachten“, erklärt Frei (Frei et. al 2024).
Zusammen Wissenschaft voranbringen
Zurück in der Schweiz, zieht es Michelle Frei erstmal in die Höhe. Beim Wandern und Sporteln kann die Wissenschaftlerin abschalten und Kraft tanken, auch für neue Projekte.
An der ETH Zürich plant sie nun Biosensoren zu entwickeln, die nicht nur Unterschiede anzeigen können (z.B. mehr oder weniger Signal), sondern auch eine Quantifizierung ermöglichen. Vor den ersten Experimenten muss aber erstmal das Labor fertig eingerichtet werden.
Auch das gehört dazu. Michelle Frei möchte ihre Studierenden ganzheitlich fit machen für die Wissenschaft: von Fachwissen, über Laborfertigkeiten bis hin zur Präsentationserfahrung. Dieser Mentoringansatz wurde bereits von ihren Studierenden in den USA sehr geschätzt. „Es freut mich sehr, wenn meine Studentin eine erfolgreiche Präsentation hält und nachher aufgeregt berichtet, sie hätte mögliche Kollaborationspartner gefunden. So geht Forschung. Der Sinn ist ja nicht, dass ich für alle denke, sondern, dass wir zusammen die Wissenschaft voranbringen.“

Michelle Frei studierte Chemie an der ETH Zürich und absolvierte ihr Doktorat bei Prof. Kai Johnsson an der EPF Lausanne und am Max Planck Institute for Medical Research in Heidelberg (2016-2020), wo sie auch Gastwissenschaftlerin am EMBL war. Für ihre Dissertation erhielt sie die EPFL Thesis Distinction sowie den Prix Schläfli Preis in Chemie. Von 2011 bis 2020 unterstützte Michelle Frei die Organisation der Schweizer Chemie-Olympiade. Gefördert durch den Schweizerischen Nationalfonds (SNF) forschte Frei als Postdoc bei Prof. Jin Zhang an der University of California San Diego (2021-2024). Seit 2024 arbeitet sie nun als Tenure-Track-Assistenzprofessorin für Chemische Biologie und Molekulare Bildgebung am D-CHAB.
Save the date
Prof. Michelle Freis Einführungsvorlesung findet am 3. April 2025 stattim Audimax, ETH Zürich Hauptgebäude statt!
Mehr Informationen folgen.
Weitere Informationen
Frei et al. (2022): Engineered HaloTag variants for fluorescence lifetime multiplexing. Nature Methods volume 19, pages65–70. externe Seite https://doi.org/10.1038/s41592-021-01341-x
Frei et al. (2024): Far-red chemigenetic biosensors for multi-dimensional and super-resolved kinase activity imaging. bioRxiv preprint. externe Seite https://doi.org/10.1101/2024.02.10.579766externe Seite